Me resulta muy llamativo la manera en que esta enfermedad afecta la "psique" colectiva de la humanidad y en similar forma e intensidad en la de cada individuo, es una seria amenaza, lo que propicia que se genere un muy alto número de investigaciones sobre la enfermedad, pues, si bien se ha rodeado de mitos y múltiples características irreales, la triste realidad para una gran cantidad de humanos, es que constituye una constante autentica que genera gran cantidad de muertes.
Cáncer femenino. Tomada de Sitios Fuente .info.
Al cáncer también se le conoce como “tumores malignos” o “neoplasias malignas”.
Estadísticas sobre el número de víctimas del cáncer existen en todos lados y en todos los tiempos, por ejemplo: se ha informado que ele cáncer es la principal causa de muerte en todo el mundo. En el año 2015 se atribuyeron a esta enfermedad 8.8 millones de defunciones en el mundo. Y se detalla la información para informarnos los cinco tipos de cáncer que causan un mayor número de fallecimientos son los siguientes:
1. Pulmonar (1 millón 69 mil de defunciones)
2. Hepático (788 mil defunciones)
3. Colorrectal (774 mil defunciones)
4. Gástrico (754 mil defunciones)
5. Mamario (571 mil defunciones)
En países en desarrollo se estima un aumento en la incidencia del cáncer del ochenta por ciento, estimando que se presentaran 21 millones trescientos mil casos para el año 2030. En 2013, la Organización Mundial de la Salud (OMS) puso en marcha el "Plan de acción mundial para la prevención y el control de las enfermedades no transmisibles 2013-2020", cuyo objetivo es reducir en un veinticinco por ciento la mortalidad prematura causada por el cáncer, las enfermedades cardiovasculares, la diabetes y las enfermedades respiratorias crónicas de aquí hasta el ya no tan lejano año 2025.
En México, ocurre que el cáncer es la tercera causa de muerte , con una participación del doce por ciento de todas las defunciones ocurridas anualmente y se concluye estadísticamente que las principales neoplasias, causantes de muerte, son: pulmón, mama, colorrectal, próstata y estómago. Cada año se estiman 148 mil nuevos casos de cáncer, 65.5 mil en hombres y 82.4 mil en mujeres. Se observa que la población mexicana, sigue en general tendencias mundiales, pero presenta diversidad en un rasgo que le caracteriza individualmente.
El cáncer no es una enfermedad nueva. Los egipcios ya lo trataban quirúrgicamente alrededor del 600 a.C. (Karpozilos y Pavlidis 2004). Hacia el 400 a.C. Hipócrates de Cos (460 - 370 a. C.) distinguió entre tumores benignos y malignos; a los segundos los llamó «carcinomas», a partir de la voz griega "carcinos", que significa «cangrejo», en referencia a la forma que observó en los tumores malignos en estado avanzado, y el sufijo -oma, que significa «inflamación». Pero aunque no es una enfermedad nueva, la incidencia del cáncer va en aumento. Las estadísticas más recientes cifran la mortalidad anual por cáncer en casi ocho millones de personas, alrededor del 13% del total de muertes (Organización Mundial de la Salud 2008). La (OMS) también predijo que en el año 2020 esta cifra habrá incrementado a 11 millones y medio. Y el pronostico resultó menor, la propia organización informó el 2 de febrero del año 2021, con motivo del "Día Mundial contra el Cáncer", conmemorado el día 4 del mismo mes, que las defunciones a nivel mundial alcanzaron los diez millones, y puntualizó que la mayoría de ellos ocurrió en países de renta baja y media. No obstante que en un sondeo la OMS mostró que la pandemia de Covid-19 interrumpió los tratamientos para el cáncer en más del cuarenta por ciento de los países, pese a que estos pacientes corren un mayor riesgo frente al coronavirus pues ha sido detectada como una comorbilidad asociada. Finalmente actualizó las estadísticas referentes, con un once punto siete por ciento de los casos nuevos, el cáncer de seno es la manifestación más común, seguido por los de pulmón, de colon y de próstata.
Es un mito que el cáncer sea una enfermedad incurable.
Así lo asegura Joan Massagué Solé, (30 - 04 - 1953) uno de los mayores expertos del mundo en esta enfermedad, actualmente dirige el programa de investigación del "Sloan Kettering Cancer Center de Nueva York". Nos recuerda que, en algunos casos, las posibilidades de superar esta enfermedad ya llegan al noventa y cinco por ciento, lo que demuestra los claros avances logrados durante décadas de investigación y mejora de los tratamientos. Pero la guerra contra el cáncer no se ha ganado y, actualmente, el peor enemigo es la metástasis, el proceso por el que el cáncer se expande a otros órganos y que es responsable del noventa por ciento de las muertes relacionadas con esta dolencia. Massagué nos cuenta pormenores de la apasionante historia de por qué era tan difícil atajar este proceso y por qué estamos más cerca de lograrlo gracias a la investigación.
Y declara que: "El cáncer se desarrolla como consecuencia de mutaciones y otras anormalidades que alteran los genes que controlan el comportamiento celular (Hanahan y Weinberg 2000; Volgestein y Kinzler 2004). Estas mutaciones pueden producirse por la acción de factores externos —cancerígenos químicos, agentes infecciosos o radioactivos— o internas debido a errores en la replicación y corrección del Ácido Desoxirribonucleico (ADN) de pequeños grupos de células a lo largo del tiempo. Además las mutaciones cancerígenas también pueden ser hereditarias, en cuyo caso se encuentran presentes en las células desde el momento de nacer. Las investigaciones actuales sobre genética se centran en los procesos que causan estas alteraciones, en los tipos de genes que se ven afectados y en sus consecuencias biológicas.
Las infecciones virales son la segunda causa externa más importante de cáncer después del tabaco (Zur Hausen 1999). Los virus asociados al cáncer en seres humanos incluyen: "el virus del papiloma" para desarrollar cáncer cervical, los "virus de las hepatitis B y C" en el cáncer de hígado, el "virus de Inmunodeficiencia Adquirid"a en el sarcoma de Kaposi y el "virus de Epstein-Barr" en linfomas de células B (Boshoff y Weiss 2002; Parato et al. 2005; Roden et al. 2006; Woodman et al. 2007; Young y Rickinson 2004).
Las infecciones virales favorecen la formación de tumores al incorporar el genoma del virus en el ADN de la célula huésped, lo que puede incrementar la actividad de genes vecinos, los cuales a su vez estimulan la división incontrolada de células. Las infecciones virales también pueden favorecer la formación de tumores causando inflamación crónica y estimulando la producción de células en los tejidos huésped. La degeneración del tejido hepático, o cirrosis, causada por el alcoholismo, está relacionada con el desarrollo de cáncer de hígado. La combinación de cirrosis y hepatitis viral constituye el principal factor de riesgo de cáncer de hígado, que es de los más comunes y con mayor índice de mortalidad. El ejemplo más claro son los cánceres gástricos relacionados con la inflamación crónica de la mucosa estomacal por infección de la bacteria Helicobacter pylori (Cheung et al. 2007; Wang et al. 2007).
Ciertos tipos de cáncer tienen un fuerte componente hereditario (Volgestein y Kinzler 2004). Tenemos que las mutaciones heredadas en los genes BRCA1 y BRCA2 crean un componente de alto riesgo de desarrollar cáncer de mama y de ovarios (Walsh y King 2007; Wang 2007; Welsch y King 2001). Es interesante que las mutaciones en genes BRCA son poco frecuentes en cáncer esporádico (aquel en el que las mutaciones genéticas no son hereditarias, sino espontáneas). Por contra, el "gen p53", que por lo general muta en los casos de cáncer esporádico, también es el gen afectado en el síndrome hereditario de Li-Fraumeni, que incluye predisposición a sarcomas, cáncer de mama y tumores cerebrales (Vousden y Lane 2007). El retinoblastoma en niños se debe a una mutación de carácter hereditario en el "gen retinoblastoma" (RB), que también muta en muchos tipos de cáncer esporádico (Classon y Harlow). Una mutación heredada del "gen APC" también puede dar lugar a la aparición de cientos de pólipos en el colon conducentes a un desarrollo temprano de carcinoma de colon (Fodde et al. 2001). Otra forma hereditaria de predisposición al cáncer es la causada por mutaciones en uno de los varios genes (MLH1, MSH2, MSH6, PMS1, PMS2) dedicados a reparar errores de replicación en el ADN. Este trastorno hereditario (llamado HNPCC, cáncer de colon hereditario sin pólipos) incluye casos de cáncer de colon sin pólipos, cáncer uterino, gástrico y de ovarios dentro de una misma familia (De la Chapelle 2004). Mutaciones heredadas en el "gen VHL1" producen una predisposición al cáncer de riñón (Kaelin 2005).
Las mutaciones hereditarias que tienen un fuerte efecto en el desarrollo del cáncer, son raras entre los seres humanos, y responsables sólo de una pequeña fracción de las estadísticas totales de cáncer. Por ejemplo, la mutación heredada del "gen BRCA" es responsable de menos de un dos por ciento de los casos de cáncer de mama (Welsch y King 2001). En el extremo opuesto del espectro, ciertas variaciones genéticas pueden tener un impacto muy leve a escala individual en el riesgo de desarrollar cáncer, pero pueden ser prevalentes en los seres humanos. En determinados casos estos rasgos genéticos pueden combinarse para crear un riesgo significativo de cáncer.
La visión predominante en la actualidad es que el cáncer surge a partir de complejas interacciones entre carcinógenos externos y el genoma individual. La identificación de estos determinantes genéticos en hoy día objeto de intensas investigaciones.
Hoy día se puede afirmar, como el hace el doctor Joan Massagué: Los genes del cáncer se dividen en dos grandes grupos. Primero cito a aquellos cuyo exceso de actividad contribuye a la aparición de cáncer se denominan "oncogenes" (Hanahan y Weinberg 2000). Los genes codifican receptores de factores de crecimiento tales como el EGFR y el HER2, transductores de señales de crecimiento como RAS, RAF y P13K, factores de supervivencia celular como el BCL2 y otros. Las mutaciones que afectan a estos genes son activadoras o de «ganancia de función».
En segundo término, están los genes cuya actividad normal previene la aparición del cáncer reciben el nombre de «supresores tumorales» y las mutaciones que los afectan en procesos cancerígenos son inactivadoras. Los supresores tumorales incluyen sensores del daño en el ADN como el ya mencionado "p53", genes que reparan los daños en el ADN como los BRCA1 y BRCA2, inhibidores del ciclo de división celular como el RB, receptores y transductores de señales inhibidoras del crecimiento como el TGFBR y el SMAD4 y supresores de señales de crecimiento como el PTEN.
Las mutaciones que afectan a estos genes pueden ser puntuales, es decir, que afectan a un solo nucleótido del gen y a un solo aminoácido en el producto del gen. Las mutaciones puntuales pueden aumentar o reducir la actividad del producto del gen, y por tanto son una causa de activación oncogénica así como de la inactivación de genes supresores tumorales. Pequeñas pérdidas o inserciones también pueden causar activación oncogénica o inactivación de los supresores tumorales. Las mutaciones a gran escala incluyen pérdida o adquisición de una porción de cromosoma que resulta en la multiplicación de uno o más oncogenes, o una pérdida de genes supresores tumorales. Las translocaciones se producen cuando dos regiones cromosómicas diferenciadas se fusionan de forma irregular, a menudo en una localización determinada. Un ejemplo conocido de esto es el "Cromosoma Filadelfia" que es una alteración genética asociada a la leucemia mieloide crónica (LMC) o conocida también como "Translocación de los cromosomas 9 y 22", que resulta en la producción de la proteína de fusión BCR-ABL (Melo y Barnes 2007). Ello causa activación oncogénica del "gen ABL". Algunas mutaciones oncogénicas afectan no sólo a la región codificadora de proteínas de un oncogén sino a la región reguladora o «promotora» encargada de controlar el producto del gen. La inserción de un genoma viral cerca de la región promotora también puede llevar a la hiperactivación de un oncogén.
Cáncer pulmonar. Tomada de Infosalus .com.
Además de las distintas clases de mutaciones que pueden alterar la estructura química de un gen normal convirtiéndolo en cancerígeno, los investigadores son cada vez más conscientes del impacto de las modificaciones epigenómicas. Éstas son modificaciones químicas del ADN y de las proteínas que lo rodean (Blasco 2007; Esteller 2007). Dichas modificaciones se conocen como cambios epigenéticos y tienen la capacidad de silenciar la expresión de un gen o de impedir que sea activado. La desregulación epigenética puede contribuir a la aparición de cáncer si no consigue silenciar la expresión de un gen o hacer que sea competente para su activación. La pérdida de metilación puede desembocar en una expresión aberrante de oncogenes. La metilación (la adición de un grupo metilo a una molécula) o la acetilación (reacción que introduce un grupo acetilo en un compuesto químico) de proteínas histonas que envuelven el ADN cromosómico también pueden sufrir alteraciones que favorezcan el cáncer. El fármaco experimental anti cancerígeno Vorinostat actúa restaurando la acetilación de las histonas y está actualmente en fase de prueba.
La "Selección Clonal": Debido a que cada tejido tiene una estructura, unos límites y una vascularización característicos, además de un entorno extracelular de hormonas, nutrientes y metabolitos. Entonces, las células cancerosas que alteran estas condiciones están expuestas a fuentes de estrés medioambiental, incluyendo, falta de oxígeno (hipoxia) y de nutrientes, a la acidez, al estrés oxidativo y las respuestas inflamatorias. Las células que sobreviven a estos agentes de desgaste se convierten en población dominante en el tumor en desarrollo. Este fenómeno se conoce como «selección clonal» (Nowell 1976). Los clones de células resultantes no son meros supervivientes sino oportunistas altamente efectivos que se benefician del microentorno del tumor.
Los tumores son más que un conglomerado de células cancerígenas, también incluyen células sanas que son atraídas y finalmente engullidas por el creciente tumor y pueden convertirse en cómplices de su desarrollo (Joyce 2005; Mueller y Fusenig 2004). El conjunto de tipos de células no cancerígenas presentes en un tumor se conoce como "estroma" y su importancia en el cáncer es cada vez más reconocida. Células endoteliales presentes en el tumor forman nuevos capilares sanguíneos que atraen nutrientes y oxígeno a la masa tumoral. Macrófagos y otras células inmunes e inflamatorias se congregan en el tumor en un intento por responder al daño infringido a los tejidos. Los macrófagos asociados a tumores producen factores de crecimiento y enzimas (ECM) degradadas que estimulan el crecimiento y la invasión de células cancerosas (Joyce 2005; Lewis y Pollard 2006). El tumor también recluta células de defensa ante el estrés del sistema circulatorio. Varios tipos de células de la sangre son atraídas por señales que emanan del tumor y proliferan en respuesta a ellas. Los factores derivados del estroma pueden a su vez estimular a las células cancerosas a liberar señales que refuercen su capacidad de producir metástasis. Por ejemplo, "la citoquina" derivada de estroma factor de crecimiento transformante tipo b (TGF-b) puede inducir a las células de cáncer de mama a liberar "angiopoyetina-like 4", que refuerza la capacidad de estas células de invadir los pulmones antes de escapar del tumor primario (Padua et al. 2008).
Así, el estroma de un tumor puede proporcionar ventajas metastásicas a las células cancerosas.
Células sanguíneas cancerosas. Tomada de Topdoctors .mx.
Y después de mucho trabajo, ha llegado la era en que la ciencia puede conquistar el cáncer y por ello, su reputación de enfermedad incurable empieza a desaparecer. Cada día nuevos avances en la investigación médica y la atención clínica contribuyen a desmontar el mito de que el cáncer es una enfermedad demasiado compleja de entender y difícil de curar. ún falta, el camino a la comprensión y el control del cáncer sigue siendo arduo, pero los recientes progresos proporcionan razones para un optimismo cauto.
Fundamentalmente el cáncer es un problema genético. Surge a partir de mutaciones y otras alteraciones patológicas en el genoma de una célula, induciendo a ésta y a sus descendientes a un comportamiento anómalo (Volgestein y Kinzler 2004). Estas alteraciones pueden heredarse en el momento de la concepción y afectar a todas las células de un organismo, pero por lo común se adquieren por accidente en un pequeño número de células en un tejido en particular. En la mayoría de los tipos de cáncer la transformación de una célula normal en cancerígena requiere múltiples mutaciones que, unidas, desactivan los mecanismos clave del autocontrol celular. Este cúmulo de mutaciones puede tardar décadas en producirse, una de las razones por la cual la incidencia del cáncer aumenta con la edad.
El cáncer, es también un problema de biología celular. Las alteraciones genéticas que dan lugar al cáncer actúan alterando el ciclo de vida normal y el comportamiento social de las células (Gupta y Massagué 2006; Hanahan y Weinberg 2000). Los genes cuya función normal sería favorecer el movimiento y la división de células pueden convertirse en cancerígenos si sufren alteraciones que incrementen dichas actividades. Por otra parte, los genes cuya función normal es la de limitar la división celular, retener a las células en su sitio, favorecer la diferenciación celular o eliminar células muertas o defectuosas, conducen al cáncer si no son activados como requieren. La identificación de células cancerígenas y de las funciones celulares que éstas controlan ocupa en la actualidad el primer plano de la investigación y del desarrollo de fármacos anticancerígenos.
La identificación de células cancerígenas y de sus funciones biológicas durante el último cuarto del siglo xx ha hecho posibles nuevas y mejores maneras de prevenir y tratar el cáncer.
Los tumores resultan de la acumulación de múltiples mutaciones en las células afectadas. Esta acumulación puede llevar años (Volgestein y Kinzler 2004). Por esta razón el cáncer es relativamente raro en niños y adolescentes y en cambio aumenta con la edad. En los países desarrollados, el aumento de la esperanza de vida y de la población de mediana edad ocurrido en las últimas décadas ha contribuido a un crecimiento generalizado de la incidencia de cáncer. Dados los progresos conseguidos en el control de las enfermedades infecciosas que en la actualidad azotan a la población de los países en vías de desarrollo, cabe esperar que crezca también la incidencia de cáncer en ellos. Otros factores desencadenantes son la detección temprana de tumores en exámenes médicos rutinarios, factores relacionados con la dieta y los hábitos de vida y el impacto negativo del tabaco.
La importancia del cáncer en nuestras sociedades de siglo XXI, Tomada de Gaceta Médica.com.
El término «cáncer» en la realidad, agrupa a cientos de enfermedades diferentes. Tumores primarios que se originan en diferentes órganos y tejidos —por ejemplo, cáncer de mama, cáncer de pulmón o leucemia— son distintos entre sí en cuanto a apariencia, evolución, respuesta al tratamiento y mortalidad. Pero además, tumores originados en un mismo órgano pueden clasificarse en subclases que difieren mucho entre sí. Existen al menos cinco subclases de cáncer de mama, e incluso éstas podrían dividirse a su vez en diferentes variedades. Lo mismo puede decirse del cáncer en otros órganos. Estas diferencias requieren, pues, distintos tratamientos, y esto es parte de la ganancia alcanzada, al poder elegir distintas herramientas para su combate, por parte de los especialistas oncólogos .
Los tumores también se clasifican de acuerdo al tipo de célula del que deriven. Los carcinomas son tumores malignos derivados de células epiteliales, tales como las que forman la capa superficial de la piel o epidermis, y en la mucosa digestiva o la estructura interna de órganos como la mama, la próstata, el hígado y el páncreas. Los sarcomas, por su parte, derivan de células de tejido conectivo como huesos, cartílagos y músculos. Los linfomas y las leucemias se originan en células precursoras; en el caso de los melanomas proceden de los melanocitos, que son las células responsables de la pigmentación de la piel, y también se incluyen: el glioblastoma, el neuroblastoma y el meduloblastoma, que proceden de células inmaduras del tejido neural.
Los carcinomas son el tipo de cáncer más común en adultos, mientras que entre la población joven son más corrientes el neuroblastoma, el meduloblastoma y la leucemia.
Una tercera serie de parámetros en la clasificación de tumores se basa en su grado de invasión, lo que se conoce como estadios de la enfermedad, y su presentación histológica cuando se observan en el microscopio, llamada grado. Sin embargo, tumores de un mismo origen, tipo, grado y estadio pueden progresar y responder a la terapia de modos muy distintos dependiendo del paciente. Este hecho tiene un gran impacto en nuestra perspectiva del cáncer como enfermedad de la que aún sabemos muy poco. Por fortuna, esto irá cambiando. La llegada de las tecnologías en genética molecular está haciendo posible una mejor clasificación de los tipos de cáncer basada en su origen específico, sus alteraciones moleculares, su riesgo de extenderse a otros órganos y su posible tratamiento, así como la selección de mejores herramientas para efectuar acciones que permitan sanar a los enfermos.
Las metástasis son la principal causa de muerte por cáncer.
Como se sabe y se menciona constantemente, una de las características del cáncer es la multiplicación rápida de células anormales que se extienden más allá de sus límites habituales e invaden otras paredes del cuerpo u órganos, lo que se le conoce como “metástasis”.
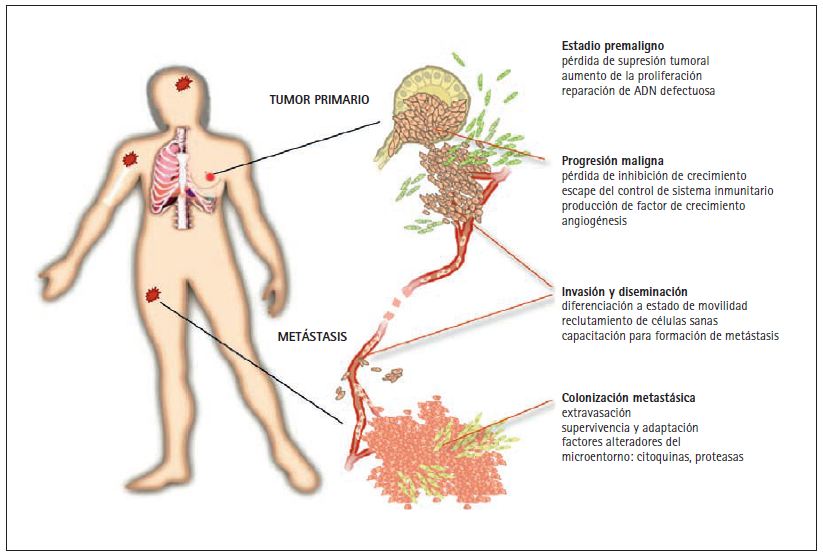
Los tumores agresivos pueden enviar millones de células cancerosas al sistema circulatorio antes de ser detectados y extirpados quirúrgicamente. La metástasis es el proceso por el cual estas células cancerosas diseminadas invaden distintos órganos y terminan por causar disfunción en los mismos y, en última instancia, la muerte (figura). Las metástasis pueden detectarse coincidiendo con el diagnóstico inicial o meses o años más tarde, cuando se produce una recidiva. Las células cancerosas diseminadas pueden permanecer en estado letárgico en distintos órganos durante largos periodos de tiempo, hasta que, por causas que se desconocen, se reactivan y empiezan a formar metástasis de crecimiento agresivo.
La formación de metástasis tiene mucho de proceso evolutivo darwiniano: de una población de células cancerosas sólo las más fuertes sobreviven a las condiciones de su entorno. La evolución requiere de la presencia de heterogeneidad genética en una población en la que los individuos más fuertes pueden ser seleccionados para sobrevivir bajo determinadas presiones ambientales. En los tumores, dicha heterogeneidad viene garantizada por la inestabilidad genómica inherente a las células cancerosas, y aumenta la probabilidad de que algunas de las células de un tumor adquieran competencia metastásica. La integridad del ADN puede verse comprometida por aberraciones en la progresión del ciclo celular, crisis teloméricas, desactivación de los genes reparadores de ADN y alteración de los mecanismos de control epigenético. Por ejemplo, la mitad de los cánceres en seres humanos sufren pérdida del supresor tumoral del gen "p53", una proteína interna que responde a los daños en el ADN causando la eliminación de la célula dañada. La pérdida de p53 permite que las células cancerosas con alteraciones en el ADN sobrevivan y experimenten sucesivas mutaciones (Halazonetis et al. 2008). Mutaciones heredadas en determinados genes reparadores de ADN están asociadas a un riesgo mayor de desarrollar cáncer. Es el caso del síndrome de cáncer colorrectal sin poliposis hereditario (Rustgi 2007) y de cánceres de mama causados por mutaciones en el BRCA1 o el BRCA2 (Marin et al. 2008).
Las células cancerosas pueden diseminarse a partir de un tumor en estadios muy tempranos del mismo. Se han detectado células cancerosas en la médula ósea de pacientes con pequeños tumores de mama (Klein et al. 2002; Schmidt-Kittler et al. 2003). Ello no significa necesariamente que las primeras células migratorias sean las que progresan hasta convertirse en metástasis, pero sí indica que la diseminación no es propiedad exclusiva de tumores grandes y en estado avanzado.
Una vez las células diseminadas alcanzan órganos distantes pueden permanecer en estado letárgico e incluso morir. Este estado puede durar años, e incluso décadas, hasta que las células cancerosas diseminadas inicien un crecimiento agresivo, como en el caso del cáncer de mama. Células cancerosas diseminadas encontradas en la médula ósea de mujeres o de ratones transgénicos con cánceres en estadios tempranos pueden activarse por trasplantes de médula ósea y causar tumores letales (Huseman et al. 2008).
La diseminación también puede darse en tumores metastásicos, que a su vez generan nuevas metástasis. Es posible que las células tumorales en circulación regresen a los mismos tumores de los que salieron. De acuerdo con esta hipótesis los tumores pueden alimentarse constantemente de su progenie más agresiva, proporcionando un mecanismo que aúna capacidad metastásica con crecimiento tumoral (Norton y Massagué 2006). Esto explicaría la persistente correlación entre metástasis y tamaño del tumor (Minn et al. 2007). El ritmo y los mecanismos de la diseminación de células cancerosas son objeto de gran atención en la investigación científica actual.
Fotografía del doctor en Bioquímica Joan Massagué Solé. Tomada de es.wikidat .com.
Los huesos, los pulmones y el cerebro son las localizaciones más frecuentes de metástasis. Sin embargo, los diferentes tipos de cáncer son proclives a extenderse a diferentes órganos (Billingsley et al. 1999; Gavrilovi y Posner 2005; Hess et al. 2006; Leiter et al. 2004). La hipótesis sobre compatibilidad entre células cancerosas diseminadas (la «semilla») y determinados órganos distantes («suelos») ya la formuló en el año 1889 Stephen Paget (1855 - 1926).
Así por ejemplo, el cáncer de mama puede extenderse a huesos, pulmones y cerebro, aunque los huesos y los pulmones son los más frecuentemente afectados.
Las metástasis de cáncer de pulmón se localizan sobre todo en el cerebro, los huesos y el otro pulmón.
Por contra, las metástasis de cáncer de próstata se dan sobre todo en los huesos y, en mucha menor medida, en los pulmones.
Pero cada tipo de cáncer tiene diferentes "huellas", estos tres tipos de tumores malignos se extienden a los huesos, en ellos forman lesiones muy distintas: las metástasis de hueso por cáncer de mama y de pulmón son osteolíticas, es decir, que se disuelven en la matriz ósea causando fracturas. En cambio la metástasis de cáncer de próstata es osteoblástica, es decir, que genera tejido óseo anormal que llena la cavidad medular. La preferencia de un tumor en un órgano por hacer metástasis dentro de ese mismo órgano también varía: los tumores en un pulmón hacen fácilmente metástasis en el otro, mientras que esto rara vez ocurre en el cáncer de mama.
Los progresos científicos que han acompañado la llegada del siglo Veintiuno hacen posible una nueva visión de las metástasis basada en una mejor comprensión de sus fundamentos genéticos, moleculares y biológicos. Este conocimiento se acumula a gran velocidad a partir de la identificación de genes cuya actividad aberrante favorece la aparición de células metastásicas. Gracias a estos avances la metástasis está pasando de ser un oscuro objeto de estudio a un problema susceptible de analizarse racionalmente, diseccionarse y, en última instancia, resolverse. Para mayor detalle de la información contenida en esta entrega de la Machincuepa Cuántica, es factible encontrar la pagina "OpenMind", y el artículo denominado "Hacia una comprensión del Cáncer", en ella se sustenta las opiniones vertidas por el doctor Joan Massagué, y se encontraran las citas bibliográficas de las diferentes aportaciones consideradas en la realización de su valiosa labor de difusión.
En este contenido se han elegido cuatro proyectos que abarcan diversos campos en la investigación respectiva, desde los remedios herbarios tradicionales, como es el dedicado a la planta del cuachalalate, hasta técnicas con el uso de tecnología de reciente factura, como es, la "Ecografía Focalizada de Alta Intensidad (HIFU), así como la inmunoterapia, aplicables al cáncer de páncreas y adicionalmente un trabajo que sugiere hacer un tipo especial y muy avanzado de análisis de laboratorio "metagenomas fecales", para detectar tempranamente, este mismo tipo de cáncer. Y finalmente una aportación sobre la proteína "Omomyc" que ayuda en el tratamiento del cáncer de mama, muy recurrente y totalmente metastásico.
Ilustración de cáncer de páncreas �. Tomada de Web Consultas.com
Muestran que compuesto del cuachalalate promueve muerte de células tumorales
Una investigación del Departamento de Toxicología del Centro de Investigación y de Estudios Avanzados (Cinvestav), del Instituto Politécnico Nacional (IPN), demostró que un compuesto del cuachalalate promueve la muerte de células tumorales, al tiempo que estimula al sistema inmunitario para hacer frente a distintos tipos de cáncer.
Fotografía del Cuachalalate, "árbol de la chachalaca", Amphipterygium adstringens, tomada de Utep.edu.
Cuachalalate. Nombre proveniente del nahuatl, "Cuachachalatli", de cuáhuitl que significa árbol, y "chachalatli", nombre de un pájaro hablador conocido como "chachalaca"; literalmente significa "árbol de la chachalaca". El nombre científico de este árbol es "Amphipterygium adstringens". Tiene la característica de ser dioico, esto es que tiene las flores unisexuales en tallos y troncos separados, con sus ramas ascendentes y torcidas, muy ramificado y con fuste corto y recto, llega a medir hasta diez metros de altura. Su corteza es gruesa, compacta y dura, ornamentada de aspecto áspero, de color café rojizo a café oscuro y con lenticelas; las hojas son obovadas, sésiles y con el borde aserrado, las cuales en ambos sexos, machos y hembras, se pierden durante seis meses del año. Las flores masculinas forman panículas y las flores femeninas se encuentran solitarias en las axilas de las hojas: Los frutos alados de entre dos y medio a cinco centímetros, son de color moreno amarillentos o moreno rojizas, con una fina nervadura; contienen de una a dos semillas muy aplanadas de cinco milímetros de largo.
Dentro de la medicina tradicional, principalmente, se utiliza la corteza, preferentemente en cocimiento, como cicatrizante de heridas y quemaduras; para atenuar enfermedades gastrointestinales como pueden ser: gastritis y ulceras en el estómago, tiene función desinflamante; para problemas bucales como ulceras y fuegos de la boca; para el sistema circulatorio ayuda a purificar la sangre, a curar várices y úlceras varicosas; también, sana golpes internos y externos, gangrena, ayuda a desintegrar cálculos renales y biliares; reduce el colesterol, ayuda a regular los niveles de glucosa en la sangre, en el sistema renal ayuda en las infecciones en los riñones y para problemas de la piel. Popularmente utilizado como un buen gastroprotector, se define como un fármacos que protege la mucosa gástrica de agentes irritantes.
Libia Vega Loyo, quien lidera la investigación, sostuvo que los beneficios de esa planta se deben a su contenido de ácido anacárdico, que es el conocido como ácido 6-pentadecil salicílico, el cual promueve la muerte programada (apoptosis) de las células tumorales sin afectar las normales. Químicamente, el ácido anacárdico es una mezcla de varios compuestos orgánicos estrechamente relacionados. Cada uno consta de un ácido salicílico sustituido con una cadena de alquilo que tiene de 15 a 17 átomos de carbono. El grupo alquilo puede ser saturado o insaturado. Por tanto, el ácido anacárdico es una mezcla de moléculas saturadas e insaturadas. La mezcla exacta depende de las especie de la planta que lo contenga, resultando letal para las bacterias "Gram positivas".
En la actualidad, el método utilizado para terminar con células enfermas es por medio de inflamación o necrosis lo que produce daños importantes en los tejidos, así como los efectos secundarios en un tratamiento de cáncer. En cambio, este ácido no mata las células sanas, solamente las induce a un arresto de la proliferación; es decir, se expanden más despacio.
Fotografía de la corteza de cuachalalate. Tomada de México Desconocido.com.
La investigadora explicó que este compuesto es capaz de estimular el sistema inmune y se observó cómo el ácido 6-pentadecil salicílico tiene una función muy específica de fosforilación sobre ciertas proteínas o cinasas, cuyo papel es dar la señal a los macrófagos para ser más reactivos y puedan responder con rapidez a retos que se les presentan; es decir, inducen la muerte de la célula tumoral y activan al sistema inmunitario para atacarla más eficientemente.
En bioquímica, una cinasa o quinasa es una enzima (proteína) que cataliza la transferencia de grupos fosfato de moléculas donantes de fosfato de alta energía a sustratos específicos. Este proceso se conoce como fosforilación, donde el sustrato gana un grupo fosfato y la molécula de "Adenosín Trifosfato" o "Trifosfato de Adenosina" (ATP) de alta energía dona un grupo fosfato. El (ATP) es un nucleotido y la molécula portadora de la energía primaria para todas las formas de vida.
Vega Loyo explicó que el estudio se realizó en modelos con cáncer de mama e in vitro, en líneas celulares de leucemia y de células provenientes del tracto gastrointestinal, específicamente del estómago; además, la línea de investigación también ha efectuado varios estudios preliminares en los que se combina el ácido 6-pentadecil salicílico con otros antineoplásicos, donde se observó una disminución de la toxicidad de la quimioterapia y se tiene la misma eficiencia farmacológica de reducción del tumor.
La investigación, fue publicada en "Toxicology and Applied Pharmacology y Molecules", en el contenido se expone que antineoplásicos como el "taxol", fármaco utilizado en tratamientos de cáncer de mama, tiene la desventaja de ser muy tóxico para el sistema inmunológico, al matar las células de la médula ósea y disminuir la cantidad de células blancas en la sangre, “que deja al paciente inmunosuprimido, muy susceptible a infecciones, y que constituye la consecuencia más grave de todas las quimioterapias”.
En contraste, el cuachalalate no violenta a las células inmunológicas, por lo que no se dan cambios significativos como puede ser una respuesta inflamatoria o alérgica, haciéndolo un compuesto muy seguro, señaló la investigadora Libia Vega Loyo.
Fotografía dela investigadora Libia Vega Loyo. Tomada de Centro de Investigación y de Estudios Avanzados del Instituto Politécnico Nacional.
Por el momento, se realizan pruebas preclínicas del uso en conjunto de los ácidos anacárdicos del cuachalalate con otros antineoplásicos clásicos empleados en la clínica como el "carboplatino", el "cisplatino", el "taxol" y el "5-fluorouracilo"; además, han encontrado una sinergia importante con el carboplatino para reducir más eficientemente tumores de mama.
Terapia dos en uno, podría alargar la vida de pacientes con cáncer de páncreas.
Células enfermas. Foto Penn Medicine / Archivo
Científicos británicos aclamaron un gran avance en la lucha contra el cáncer de páncreas con el desarrollo de un tratamiento dos en uno que podría aumentar significativamente las tasas de supervivencia, que apenas han mejorado en los cincuenta años pasados, según publicó The Independent.
Expertos del Instituto de Investigación del Cáncer de Londres combinaron dos tratamientos ya utilizados en hospitales como parte de su investigación y los probaron en ratones.
Uno de ellos es la inmunoterapia, que consiste en un medicamento que estimula al Sistema Inmunitario para combatir el cáncer. El medicamento bloquea la proteína que impide que ese mecanismo de defensa ataque las células cancerosas y ha tenido un gran éxito contra algunos tipos de esa enfermedad.
Sin embargo, en el caso de los tumores de cáncer de páncreas, existe una situación que impide la acción de estimulación al Sistema Inmunitario, pues estos tumores, tienen una capa externa gruesa que impide que el medicamento rompa la barrera.
El segundo tratamiento consiste en una Ecografía Focalizada de Alta Intensidad (HIFU) que destruye el tumor con pulsos de ondas sonoras. Esto crea pequeñas burbujas en las células que rebotan vigorosamente y perforan agujeros en la barrera protectora lo que permite que el medicamento antes mencionado funcione de manera efectiva.
Los ratones con tumores pancreáticos que recibieron el tratamiento combinado vivieron un veinticinco por ciento más que a los que solamente se les administró HIFU, y el treinta y cinco por ciento más que los que sólo tomaron el medicamento, pero también lograron vivir un cuarenta por ciento más que los que no recibieron tratamiento terapéutico alguno.
El investigador Petros Mouratidis señaló que dicha terapia podría agregar varios meses de vida en humanos, pero a los ratones sólo se les dio un tratamiento único, y los científicos esperan que el método dos en uno pueda curar el cáncer de páncreas si se administra por un tiempo prolongado.
Si los ensayos en humanos tienen éxito, se ha estimado que los tratamientos podrían estar en uso generalizado dentro de cinco años.
Ilustración del Páncreas. Tomada de medlineplus.gov.
Mouratidis también es optimista en cuanto a que el tratamiento funcionará en la enfermedad, que es vital ya que la mayoría de los casos de cáncer de páncreas no se diagnostican hasta que ha hecho metástasis, diseminándose por todo el cuerpo. La afección en ese órgano a menudo también es difícil de detectar de manera temprana, ya que éste se encuentra en un lugar muy profundo del cuerpo, por lo que los tumores no se pueden ver ni sentir. La enfermedad a menudo tampoco muestra síntomas hasta que el tumor ha crecido y se ha diseminado a otras partes.
Chris MacDonald, jefe de investigación de Pancreatic Cancer UK, aseguró: “Se necesita más investigación, pero el potencial de esta combinación es emocionante y subraya la importancia de probar enfoques nuevos e innovadores. Se necesitan desesperadamente más opciones de tratamiento si queremos incrementar la supervivencia de los futuros pacientes”.
La enfermedad es la sexta causa más común de cáncer en el Reino Unido y la quinta mayor causa de muerte por cáncer, causando alrededor de nueve mil cuatrocientos fallecimientos al año.
La situación se agrava, si se considera que más de la mitad de las diez mil quinientas personas con cáncer de páncreas mueren dentro de los tres meses posteriores al diagnóstico, y sólo una de cada cuatro vive durante un año o más.
Imagen de Análisis para detectar Cancer de Pancreas. Tomada de Webconsultas .com
Pero también, se ha incursionado en este mismo tipo de cáncer que el análisis de heces podría ayudar a detectar tempranamente este tipo de cáncer, lo que se ha publicado, en esta misma semana en la revista "Gut", que es una de las más prestigiosas en los campos de la gastroenterología y hepatología. Las pacientes incluidas en estos ensayos procedían de los hospitales españoles: "Ramón y Cajal", situado en la ciudad capital, Madrid y "Vall d’Hebron", ubicado en Barcelona.
Expertos del Centro Nacional de Investigaciones Oncológicas (CNIO), liderados por Núria Malats, y del Laboratorio Europeo de Biología Molecular (EMBL, Heidelberg), dirigidos por Peer Bork, encontraron una firma molecular de veintisiete microorganismos en muestras de heces que podría detectar a los pacientes de alto riesgo de "adenocarcinoma pancreático ductal", que constituye el cáncer de páncreas más frecuente, e incluso llegar a diagnosticar a los que están en estadios muy tempranos de la enfermedad.
Se ha solicitado una patente sobre estos resultados para desarrollar un kit de diagnóstico de cáncer de páncreas que detecte estos genomas microbianos en muestras de heces, de forma rápida, no invasiva y barata, pues es urgente y necesario disponer de pruebas que sean capaces de detectar de forma temprana esta enfermedad y mejorar la supervivencia de los pacientes.
El cáncer de páncreas no es de los cánceres más frecuentemente diagnosticados, pero sí de los más letales: representa la tercera causa oncológica de muerte en España, detrás del de pulmón y el colorrectal, y séptima en el mundo. El diagnóstico tardío y las limitadas opciones terapéuticas son algunas de las razones que propician estas altas tasas de mortalidad.
Fotografía de los científicos Nuria Malats y Peer Bork. Tomada de Innovaspain.com
Indicaron los líderes de los equipos de investigadores: Nuria Malats y Peer Bork: "Este tipo de cáncer es muy silencioso, no proporciona sintomatología que avise de su existencia, es regla general que los síntomas aparecen ya en las últimas fases de la enfermedad, cuando los tumores ya no pueden ser eliminados por cirugía, y en muchos casos, una vez que se detecta es demasiado tarde. Necesitamos diagnosticar la enfermedad en estadios mucho más tempranos, antes de que aparezcan los síntomas, y para ello tenemos que identificar y definir la población de riesgo y disponer de buenas pruebas de cribado para detectar el cáncer cuando todavía es curable. Análisis muy avanzados a nivel bioestadístico y bioinformático nos permitieron construir una firma de 27 microbios procedentes de heces, la mayoría bacterias, que discriminan muy bien los casos con cáncer de páncreas de los controles, tanto en sus fases más avanzadas como en las más tempranas”.
Así mismo se ha informado que esta "firma genética" ha sido validada en un estudio independiente llevado a cabo en dos hospitales de Alemania y, adicionalmente en veinticinco estudios realizados en dieciocho países, que constan de cinco mil 792 "metagenomas fecales". Finalmente ha sido reportado que en la actualidad se estudia en población japonesa.
Encuentra que la proteína "Omomyc" es eficaz agente antimetastásica en cáncer de mama.
"Omomyc", es una proteína terapéutica desarrollada en el Vall d’Hebron Instituto de Oncología (VHIO) ya usada para controlar muchos tumores primarios, demostró por primera vez su capacidad antimetastásica frente al cáncer de mama.
Desde hace tiempo se sabe con certeza que el "gen MYC" desempeña una función importante en el desarrollo de muchos tipos de tumores. En cambio, existe cierta controversia sobre cómo puede afectar al desarrollo de las metástasis y algunos estudios sugieren incluso que inhibir al (MYC) podría potenciar ese proceso.
Daniel Massó y Laura Soucek, científicos investigadores del Vall d’Hebron Instituto de Oncología de Barcelona, España. Foto tomada del Twitter de @VHIO.
Ahora, este nuevo trabajo aporta, por primera vez, luz sobre tema. En concreto, se ha analizado la eficacia de "omomyc", proteína inhibidora de (MYC), para controlar la progresión del cáncer de mama metastásico, y los resultados obtenidos han sido “muy positivos”.
En la investigación, cuyos resultados se publican en la revista "Cancer Research Communications", se efectuaron diferentes experimentos tanto "in vitro" como "in vivo", a fin de conocer de qué manera impactaba en las metástasis del cáncer de mama.
“La respuesta ha sido muy positiva y en todos los casos se ha podido comprobar que tiene una importante actividad antimetastásica, en contra de lo que se había especulado”, señaló Daniel Massó, investigador de Peptomyc y primer autor del trabajo.
Agregó Laura Soucek, codirectora de Investigación Traslacional y Preclínica y jefa del Grupo de Modelización de Terapias Antitumorales del (VHIO), profesora investigadora de Icrea y cofundadora y directora ejecutiva de Peptomyc, quien también participó en esta investigación: “Hasta el momento habíamos demostrado que omomyc era eficaz para controlar muchos tumores primarios. Ahora, además, hemos visto que es un fármaco eficiente al bloquear la invasión, el establecimiento y el crecimiento de las metástasis en el cáncer de mama”.
Hace décadas que la investigación oncológica ha puesto de manifiesto que el "gen MYC" tiene una importante función en el desarrollo de la práctica totalidad de los tumores sólidos. Sin embargo, también había una creencia generalizada de que se trataba de una diana inalcanzable.
Sin embargo todo cambió hace más de veinte años, cuando Soucek se planteó que esto no tenía por qué ser así. Fruto de su esfuerzo y trabajo nació omomyc, una miniproteína capaz de inhibir a MYC, que, tras múltiples estudios preclínicos cuyos resultados han dado la vuelta al mundo, ya se está probando en pacientes, en un ensayo clínico iniciado en mayo del año pasado en VHIO.
Antes del ensayo, "omomyc" ya había demostrado una potente actividad en múltiples líneas de células tumorales y modelos de cáncer en ratón, independientemente del tejido de origen y de sus mutaciones.
Imágenes de lesiones de cáncer de mama. Tomada de Elsevier.com.
Sin embargo, todos los trabajos de investigación realizados hasta ahora con este fármaco, se han centrado en tumores primarios y nunca se había probado su eficacia contra la enfermedad metastásica.
Algunos estudios sugerían que MYC podía desempeñar una función antimetastásica, por lo que su inhibición podría ser perjudicial.
Es la opinión del doctor Joan Massagué, la que indica con claridad el futuro de las investigaciones respectivas:
Los nuevos conocimientos acerca de las bases moleculares, genéticas y celulares del desarrollo y la progresión del cáncer traen consigo nuevas oportunidades de mejorar y expandir nuestra capacidad de prevenir, detectar y tratar esta enfermedad. Trabajando en estrecha colaboración, científicos y médicos pueden generar y aplicar los conocimientos necesarios para hacer del cáncer una enfermedad crónica más en las próximas décadas.
La mejora de los métodos de evaluación del riesgo de cáncer y de las campañas de prevención ha hecho disminuir la incidencia, así como la mortalidad, de ciertos tipos de cáncer. Procedimientos quirúrgicos menos invasivos, métodos de radioterapia más refinados y el perfeccionamiento de los medicamentos empleados en quimioterapia están contribuyendo al éxito creciente del tratamiento del cáncer convencional. Asimismo, una mejor comprensión de su biología y genética están posibilitando el desarrollo de nuevos y mejores medicamentos que tratan las células cancerígenas sin afectar a las sanas. Y aunque por ahora estos medicamentos aún llegan por goteo, vendrá el día en que este goteo se convertirá en inundación. La consecución de estos objetivos puede muy bien ser una de las grandes hazañas científicas del siglo XXI.
La Machincuepa Cuántica seguirá en la búsqueda de contenidos sobre estas cerca de cien diferentes enfermedades agrupadas bajo el término "cáncer".

















Comentarios
Publicar un comentario