Embriología: Con dos distintas técnicas crean en laboratorio blastocistos a partir de células humanas
El "blastocisto" es una estructura embrionaria presente en las etapas tempranas del desarrollo durante el embarazo de mamíferos (embriogénesis), que ocurre de entre cuatro a seis días después de la fecundación y antes de la implantación al "endometrio". Se conforma como una "masa de células" que presenta una cavidad central llena de líquido llamada "blastocele" y está rodeada por dos capas celulares diferentes. La capa celular externa "trofoectodermo" es la que dará lugar a "la placenta" y la capa celular interna, la que dará lugar al "embrión".
Desde las ciudades de Tokio y Washington, con la partipación de las Agencias noticiosas AFP y AP, se informa el resultado obtenido por dos equipos de investigadores, cuyos trabajos se publicaron el miércoles 17 de marzo en la revista "Nature", los que siguiendo métodos diferentes para producir en laboratorio, desarrollaron, un "blastocisto", que al denotar su condición artificial se le asignó la etiqueta de "blastoide", y que constituye la primera fase del embrión, su obtención ocurre unos cinco días después de la fecundación.
Esas estructuras en un fase temprana podrían ayudar a desvelar la “caja negra” que contiene información precisa del desarrollo de las primeras etapas del proceso en humanos y promoverá la investigación sobre abortos espontáneos y malformaciones físicas en fetos.
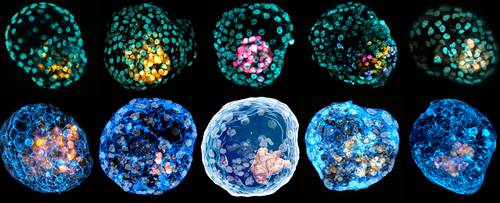
Fotografía. Combinación de imágenes microscópicas que muestra diferentes blastoides, estructuras parecidas a embriones humanos. Tonmada deLa Jornada. Foto Ap
Ambos equipos pudieron usar células humanas para crear los "blastocistos artificiales", una etapa temprana de la concepción que ocurre pocos días después de la "fertilización" de un óvulo pero antes de "la implantación" y el desarrollo de un "embrión" en el útero.
Los científicos participantes en los proyectos abundaron su explicación: "Esta esfera de alrededor de doscientas células ya presenta una estructura compleja (una capa de células externas –la futura placenta– que rodea una cavidad llena de líquido que contiene una masa de células embrionarias)". Y subrayaron que su trabajo es sólo para la investigación, no para reproducción, pero, es probable que plantee nuevas preguntas éticas.
Los "blastoides" obtenidos por ambos equipos difieren de los "blastocistos naturales": puesto que contienen células de tipo indeterminado y no figuran ciertos elementos que provienen específicamente de la interacción entre el óvulo y el espermatozoide.
Hasta ahora, la investigación sobre los "blastocistos" humanos dependía de las donaciones de los procedimientos de la "Fertilización in Vitro" (FIV), que son escasas y difíciles de obtener.
"Fertilización in Vitro" (FIV), tomada de Espacio Perinatal com.
El doctor por la Universidad de Tennessee, Jun Wu, investigador sénior del primer equipo internacional, y profesor asistente de biología molecular del Centro Médico del Suroeste de la Universidad de Texas, en Dallas, señaló: “Estudiar el desarrollo humano temprano es realmente difícil. Es básicamente una caja negra. Es decir, creemos que nuestro modelo puede abrir este campo, si se prueba la hipótesis sin usar embriones humanos”. Y agregó: "Se pueden evaluar las hipótesis sin usar embriones humanos reales".
"Dos tercios de los gemelos idénticos se desarrollan durante la etapa de "blastocistos", y "los defectos [a nivel] de blastocisto humano son una causa de los abortos espontáneos", anotó Teresa Rayon, becaria postdoctoral en entrenamiento en dinámica del desarrollo del Instituto Francis Crick, un centro de investigación biomédica en Inglaterra.
Los investigadores del equipo del doctor Wu se apresuraron a anotar que estos "blastoides" presentan diferencias clave respecto a los "blastocistos humanos", y no podrían originar un embrión viable ni usarse para crear una vida humana.
El equipo de Wu recurrió al uso de células madre derivadas de adultos para generar estas estructuras parecidas a los "blastocitos".
"Algunos científicos utilizan "blastocistos" donados por clínicas de fertilidad para investigar las causas de la infertilidad y las enfermedades congénitas. Los procedimientos creados por los dos equipos se pueden usar para producir cientos de "blastocistos" de forma eficiente para su uso en la investigación de laboratorio y el nuevo trabajo debería permitirles hacer este análisis a escalas mucho mayores", indicó el doctor José Polo, quien dirigió el segundo estudio, es investigador sénior del otro de los equipos y se desempeña como profesor de biología de la Universidad Monash, en Melbourne. Y agregó: "Esta capacidad de trabajar a escala revolucionará nuestra comprensión de las primeras etapas del desarrollo humano. Ahora, nos permitirán estudiar a escala los pasos muy iniciales del desarrollo humano, sin tener que usar "blastocistos" donados de la FIV. Lo que sin duda abrirá una gran ventana a esas semanas iniciales del desarrollo humano".
Las investigaciones futuras podría usar estos "blastocistos" artificiales, que los equipos han llamado "blastoides", para examinar en el laboratorio por qué ocurren abortos espontáneos y defectos congénitos, además de los efectos de fármacos, toxinas y virus en los embriones que ocurren en los primeros tres a 10 días tras la concepción, pormenorizó el doctor Polo.
Al respecto, comentó la doctora por la Universidad de Melbourne, Amander Clark, miembro del equipo de Polo y catedrática de biología molecular, celular y del desarrollo de la Universidad de California, en Los Ángeles"Son estructuras organizadas parecidas a un embrión, modeladas en el embrión humano, pero en mi opinión, no los considero equivalente a un blastocisto humano proveniente de una fertilización in vitro".
El equipo de Polo creó sus "blastoides" al reprogramar células cutáneas humanas y cambiar su identidad celular para formar un conjunto de células mixtas parecidas a las que se encuentran en un embrión humano temprano.
Reunieron las células en un andamio de "gelatina" tridimensional, y encontraron que las células comenzaron a interactuar y organizarse en un estructura redonda similar a un blastocisto humano. Llaman a su descubrimiento blastoides inducidos, o iBlastoides.
Para esta ocasión y por primera vez, los científicos utilizaron células humanas para hacer estructuras que imitan las etapas iniciales del desarrollo, lo que, según explicaron: "allanará el camino para más investigación sin evitar restricciones al uso de embriones reales".
Doctor Jose Polo de la Monash University, tomada de LaNacion.ar
Al referirse a la aportación realizada, el doctor Peter Rugg-Gunn, quien es líder del grupo de Investigación Genética del Instituto Babraham, en Reino Unido, aseguró: Los dos estudios "proveen un avance emocionante". Y amplio su declaración diciendo: "El trabajo subraya la notable capacidad de las células de organizarse a sí mismas y formar estructuras complejas. Algo impresionante es que, incluso en estos primeros experimentos, se forman subestructuras definidas que parecen imitar a los eventos fundamentales del desarrollo temprano, abriendo así este proceso para la observación experimental y el estudio. La investigación provee un importante nuevo modelo celular para estudiar el desarrollo humano temprano, lo que podría conducir a una mejor comprensión de la infertilidad y la pérdida temprana del embarazo".
Ilustración tomada de Es educaplay.com
Así es el desarrollo del inicio la vida de un ser humano, presento este resumen:
Después de la "fecundación", el producto resultante se denomina "cigoto", que es una sola célula y ella inicia un proceso de división, conocido como "segmentación", el que ocasiona un incremento del número de células que conforman el original cigoto unicelular, estas reciben la denominación de "blastómeras" y esto se logra a través de la "mitosis".
Las "blastómeras" se dividen veloz y repetidamente durante los primeros días de la gestación aunque el tamaño del embrión permanece constante (aumenta el número de células pero no su tamaño). Pasados de tres a cuatro días, el huevo fecundado tiene más de 32 blastómeras, recibiendo a partir de ese momento el nombre de "mórula".
Posteriormente se inicia un proceso que determinará la formación de los diferentes órganos y tejidos de acuerdo con un patrón establecido para dar lugar a un organismo final. A dicho proceso se le conoce como "diferenciación celular" y es mediante el cual las células jóvenes, inmaduras, es decir no especializadas, adoptan características individuales y alcanzan su forma y función como células maduras, esto es, logrando ser especializadas para efectuar una función o perfil funcional específico.
Durante este proceso de "diferenciación celular" existen tres etapas: blastulación, gastrulación y organogenesis. Al concluir el desarrollo embrionario, el organismo resultante recibe el nombre de feto y completará su desarrollo hasta el momento del parto.
La antes mencionada "masa de células" tiene el aspecto de una pequeña pelota y se denomina “mórula”. La mórula se ahueca, se llena de líquido y entonces le llamamos “blastocito”. Al final de esta semana, el blastocito se adhiere al endometrio, que es la pared del útero. Este proceso se denomina “implantación”.
La "Gonadotropina Coriónica Humana" (hCG) es la hormona encargada de producir "progesterona" una vez logrado el embarazo, dado que estimula al útero para la tarea reproductiva..
En resumen se tiene que la "mórula" precede a la "blástula" y esta da lugar a la "gástrula" en la secuencia de desarrollo normal de cualquier animal; se considera que el organismo está en dicho estado (como blastula) cuando presenta más de 64 células. La blástula temprana presenta todas las células sin aumentar el volumen inicial del blastocisto.
La "Gástrula" es el tercer estadio embriológico, que es el resultado de una re-estructuración de las células del segundo estadio (Blástula), por medio de una invaginación llamada gastrulación, este es el proceso mediante el cual el embrión adquiere la tres capaz germinales, a saber: ectodermo, mesodermo y endodermo.
Gastrula, tomada de EstudiaEmbriologia.blogspot.com
Se sabe que del total de embriones el porcentaje de ellos que llega a convertirse en "blastocisto", oscila entre un 40% y un 60%. Lo más habitual es que los embriones de mejor calidad sigan creciendo y los de peor calidad se detengan.
La organogénesis es el conjunto de cambios que permiten que las capas embrionarias (ectodermo, mesodermo y endodermo) se transformen en los diferentes órganos que conforman un organismo. La "Embriología Humana", le define como el período comprendido entre la tercera a la octava semana de desarrollo. Es la etapa más delicada y en el que las influencias externas van a producir mayores consecuencias adversas, al condicionar el buen desarrollo de los diversos órganos del cuerpo humano.
Ectodermo: se diferencia para dar lugar al sistema nervioso (médula espinal, nervios periféricos y cerebro), el esmalte dental y la epidermis (las partes externas del integumento). También forma el revestimiento de la boca, ano, fosas nasales, glándulas sudoríparas, pelo y uñas.
Esodermo se diferenciará en cinco tipos que formarán los distintos "Tejidos Mesenquimales" también llamado "mesénquima", que es el tejido primitivo mesodérmico, y del que derivan gran parte de los tejidos orgánicos. Asimismo por el proceso de diferenciación tisular da lugar — a vasos sanguíneos y órganos cardiovasculares, músculo liso, mesotelio, sistema linfático y tejido conectivo propiamente dicho. Además del aparato excretor.
Está compuesto por una sustancia fundamental, muy tenue, con apenas fibras y fibroblastos activados. El "mesénquima" hace referencia también a los tejidos de sostén o de relleno que conforman los órganos, en contraposición al parénquima o tejido principal de un órgano.
Endodermo formara el tubo digestivo y las glándulas asociadas, revestirá con tejidos específicos algunos órganos. Además de las amígdalas, la faringe, la laringe, la tráquea, los pulmones, y el tracto gastrointestinal (a excepción de la boca, el ano, y parte de la faringe y el recto; que provienen del ectodermo). Forma el epitelio de la Trompa de Eustaquio y la cavidad timpánica (en el oído), la vagina, la uretra y la vejiga urinaria.
Y al concluir la duodécima semana de desarrollo embrionario, el nuevo ser se denomina feto. Durante la vida fetal no se forman órganos o tejidos nuevos, sino que se produce la maduración de los ya existentes. En el ser humano el cambio de embrión a feto se produce aproximadamente luego de once semanas de iniciado el embarazo.
Es ahora que apreciamos que la duración de las distintas etapas del desarrollo de un nuevo ser humano, no presenta plazos exactos, si son de carácter similar en todos los casos, pero existen variaciones, lo que implica que no se pueda asegurar el cumplimiento absoluto de plazos, y eso no es de nuestro gusto, pues a los Homo sapiens, nos satisface la exactitud.
Sin embargo, si es bastante preciso que en esta etapa comienza el proceso de creación de la masa encefálica, el corazón y los pulmones; también se van formando las cavidades auditivas, para finalmente formar las extremidades, los músculos y órganos restantes.
En específico, en lo que se refiere al corazón, se conoce el proceso de su formación. Procede de la capa conocida como mesodermo, en el área cardiogénica da lugar a dos estructuras simétricas que reciben el nombre de cuerdas cardiogénicas, las cuales se ahuecan para originar los dos tubos endocárdicos. A partir del día 21 del desarrollo embrionario, los dos tubos endocárdicos se fusionan y forman el "tubo cardíaco primitivo". El mismo que para el día 22 de vida intrauterina se convierte en una área subdividida en cinco regiones. Estas se transforman en cada uno de los componentes del órgano, así como de las principales vías del riego sanguíneo. Resumiendo, después de unas cinco semanas en el centro del embrión donde se ha producido el "abultamiento" antes descrito, conjuntamente con los primeros vasos sanguíneos, evoluciona en el músculo cardíaco y su aparato cardiovascular. Entre las semanas sexta y séptima, el corazón empieza a bombear sangre en los vasos mayores y ello implica que ya late el corazón y lo hace con un ritmo regular. El corazón es el primer órgano funcionante del embrión.
Por su parte el "Sistema Nervioso Central" (SNC) se forma a partir del "ectodermo" En la tercera semana del desarrollo embrionario humano aparece el "neuroectodermo" y forma la "placa neural" a lo largo del lado dorsal del embrión.
Esta "placa neural" es la fuente de las células del SNC del organismo, en primer lugar, de la mayoría de las células conocidas con el nombre de neuronas, estas células nerviosas, tienen un cuerpo celular, que comprende el núcleo, así como una fibra de ramificación principal, el axón, y numerosas fibras de ramificación más pequeñas, llamadas, dendritas y que son las encargadas de efectuar los procesos de comunicación y presentan la particularidad de poseer una vaina de mielina, que es una materia grasa, cuya función es la de recubrir, de aíslar y protege los nervios del cerebro y de la médula espinal.
En segundo término, las "células gliales" que forman un sistema de soporte del SNC, y que resultan esenciales para su adecuado funcionamiento. A diferencia de las neuronas, estas últimas, no cuentan ni con axones, ni dendritas, ni conductos nerviosos, este sistema de soporte adopta las funciones del tejido del sistema nervioso y no participa directamente en la comunicación.
Se estima que el número de neuronas que conforman el cerebro supera los cien mil millones, y las gliales, supera entre cinco y diez veces el número de neuronas. A la fecha se a descubierto que las células gliales, no solamente participan en el mantenimiento de la "citoarquitectura" del cerebro, sino que además establecen una estrecha relación con las neuronas a través de sistemas denominados "neurogliales", que se encargan de mantener la "homeostasis cerebral".
Homeostasis, es una palabra que proviene del griego (hómoios), que significa: "constante", y (stasis) que significa "mantener", "estabilidad", "estado similar", para describir los mecanismos que mantienen constantes las condiciones del medio interno de un organismo, a pesar de grandes oscilaciones en el medio externo. Esto es, funciones como la presión sanguínea, temperatura corporal, frecuencia respiratoria y niveles de glucosa sanguínea, entre otras, son mantenidas en un intervalo restringido alrededor de un punto de referencia, a pesar de que las condiciones externas pueden estar cambiando.
Un surco se forma a lo largo del eje largo de la placa neural y, para la cuarta semana de desarrollo, la placa neural se envuelve por encima de sí mismo para crear el "tubo neural", el cual se llena de líquido cefalorraquídeo. Y se va transformando en las tres regiones anatómicas primarias.
Entre las semanas sexta y octava, el cerebro y la médula espinal empiezan a formarse, así como también el tracto gasto intestinal. El cerebro se transforma en un órgano dividido en cinco áreas, las que formaran la corteza cerebral, el bulbo olfatorio, la amígdala y los ganglios basales, el tálamo e hipotálamo, cerebelo y puente pons y la médula espinal.
Y en este punto, intuí, que sin bien, la embriología tradicional, ha otorgado una gran cantidad de aportaciones sobre el tema, hay nuevos campos de investigación, dado por nuevas especialidades, que utilizan novedosas herramientas tecnológicas, singulares punto de vista, nuevos supuestos en los que se fundamentan las nuevas teorías: las ciencias Neuroembriología, la Bioquímica, la Genética, la Biología Molecular, etc.
Y corroboré el notable avance de las ciencias médicas, ello me llevó a conocer lo referente a las nuevas investigaciones y sus descubrimientos, lo que a su vez, me llevó a consultar mucho material existente y por su contenido, muy especializado, pero a la vez descrito con lenguaje sencillo, para un profano como soy yo, elegí, pues me pareció adecuado incorporar sus comentarios a esta entrega de la "Machincuepa Cuántica".
El trabajo se denomina: "Desarrollo "neuroembriológico": el camino desde la proliferación hasta la perfección", y fue elaborado por:
Cristhian Eduardo Hernández-Flórez (a), Mónica Andrea Beltrán (b), Gustavo Adolfo Contreras (c). De la Universidad Industrial de Santander, Colombia, del 20 de marzo de 2018, y cuyas especialidades son:
- a Médico y cirujano. Miembro del Grupo de Genética Humana, Universidad Industrial de Santander, Bucaramanga, Colombia.b Médica especialista en Ginecoobstetricia y Perinatología, Departamento de Ginecología y Obstetricia, Hospital Universitario de Santander-Universidad Industrial de Santander, Bucaramanga, Colombia.c Médico especialista en Genética Médica. Especialista en Bioética. Departamento de Pediatría, Hospital Universitario de Santander-Universidad Industrial de Santander, Bucaramanga, Colombia.
Un extracto del mismo se propone en seguida:
"El desarrollo neurológico humano requiere una serie de pasos que permitan orientar, regular y diferenciar los diversos componentes cerebrales, para así garantizar, de una manera bastante precisa, la correcta organización y funcionamiento de las estructuras neuronales. La neurogénesis está clásicamente dividida en cuatro etapas consecutivas: proliferación, migración, diferenciación y maduración. En los humanos, estas ocurren desde la tercera semana de gestación hasta la vida adulta y precisan de un complejo grupo de paquetes genéticos, así como de algunos factores asociados, que se han ido descubriendo gracias a los avances en la biología molecular.
...El índice de celularidad encontrado en las muestras mediante análisis con cuantificación de ADN (unidades de ADN/ gramo de tejido) por el método de Zamenhof (4) debe suponer el desarrollo de una población cerebral adulta cercana a los cien mil millones de neuronas, comunicándose entre ellas y cada una con más de mil de otras neuronas, lo que genera alrededor de 60 billones de conexiones neuronales o sinapsis (8).
4. Dobbing J, Sands J. Quantitative growth and development of human brain. Arch Dis Child. 1973;48:757-67.
8. Stiles J, Jernigan TL. The basics of brain development. Neuropsychol Rev. 2010;20:327-48.
...Para ello se requiere una serie de procesos en que interactúan múltiples genes, los cuales median desde la proliferación celular hasta la creación de verdaderos circuitos nerviosos. Estos llegan a ser tan complejos que se estima que cerca de un tercio del genoma humano está destinado solo para garantizar el correcto desarrollo, mantenimiento y comunicación de las estructuras nerviosas (9). Según la literatura, el desarrollo del SNC se puede dividir en cuatro grandes periodos (7) consecutivos:
7. Stolp H, Neuhaus A, Sundramoorthi R, Molnár Z. The long and the short of it: Gene and environment interactions during early cortical development and consequences for long-term neurological disease. Front. Psychiatry. 2012;3:50.
9. Dimecky SM, Kim JC. Molecular neuroanatomy’s “Three Gs”: A primer. Neuron. 2007;54:17-34.
Proliferación: semanas 1 a 7.
Migración: semanas 8 a 15.
Diferenciación: semanas 16 a 26.
Maduración: semanas 27 a adultez.
...La neuroembriología es, sin duda, un área fascinante y de rápido desarrollo. De la mano con la genética y la biología molecular, se han ido revelando poco a poco las piezas que arman el rompecabezas del desarrollo cerebral. Esto al tiempo que se vislumbran, cada vez más cerca, posibilidades reales de pronóstico y tratamiento para las malformaciones del SNC. Los avances en las ciencias básicas enlazados con la clínica establecerán el camino para el manejo de las enfermedades relacionadas con este sistema.
Desarrollo Embriologico, Mutacion Genes EMX2 y PAX6, tomada de Redalyc.org
Ahora se conocen algunos genes específicos, como los mencionados: Rho, Rab, Pax6, Nr2e1 y Emx2, que poseen funciones particulares en la organización neuronal. También se están esbozando las líneas de migración y se han transcrito varios de los procesos que indican la propia diferenciación del epitelio germinal. Sin embargo, todavía falta una gran cantidad de datos que permitan predecir, si no es que manipular, los circuitos de información interneuronales y, en general, los mecanismos de proliferación y diferenciación celulares. Por tanto, el entendimiento molecular del proceso de desarrollo neuronal brindará verdaderas herramientas de prevención, diagnóstico y tratamiento para estas patologías.
Hoy en día la neuroembriología es un campo en desarrollo. Esta revisión nos abre la puerta para proponer estudios basados no solo en la formación estructural del SNC, sino en indagar los mecanismos moleculares y vías de señalización celular. Teniendo en cuenta que tenemos un campo de acción clínico, es interesante establecer una línea de investigación que pueda unir tanto el área de ciencias básicas como clínica.
Hasta aquí el magnifico trabajo de los doctores colombianos.
La vida intrauterina plantea aún muchas interrogantes al mundo de la ciencia, pero cada día se realizan nuevos y asombrosos descubrimientos; desde la interacción que existe entre gemelos en el útero o cómo los fetos pueden reconocer sonidos y voces desde muy temprano, hasta conocer complejos procesos asociados a la formación del cerebro y sus tempranas capacidades.
Así, por ejemplo, se ha visto que a las 22 semanas de gestación, el feto ya muestra actividad cerebral, aunque en forma intermitente, ya es posible realizar la medida a través de un encefalograma, y dos semanas después, la señal será continua. Es aproximadamente en la semana 24 que aparecen patrones básicos de sueño y vigilia.
En tanto, a la semana 26 se establecen las primeras conexiones cerebrales, un proceso que se realiza en forma más acabada en la semana 30. Asimismo, se ha observado que fetos en el tercer trimestre tienen cierta habilidad de “aprender”, es decir, de acostumbrarse a estímulos determinados e, incluso, dar respuestas de memoria a corto plazo.
Para determinar en qué momento un feto comienza a sentir dolor, en primer lugar habrá de definirse lo que ello significa. En consecuencia directa de que no existe un parámetro claro que lo indique, ni tampoco, sobre el cual exista consenso.
Sin embargo, el concepto más frecuentemente expresado en el ámbito científico es que los fetos son capaces de sentir dolor a partir de la 26 semana en adelante”.
En efecto, varias investigaciones han demostrado que a partir de ese momento el feto ya cuenta con los circuitos cerebrales necesarios para sentir esta sensación y que se producen reacciones bioquímicas similares a lo que consideramos dolor.
“La experiencia personal también muestra que los recién nacidos prematuros extremos presentan respuestas frente a estímulos dolorosos, incluyendo los nacidos desde las 26 semanas en adelante”, indica el doctor Jorge Andrés Carvajal Cabrera, que es un especialista en medicina materno fetal, como gineco-obstetra de la División de Obstetricia y Ginecología Universidad Católica, Chilena.
Asimismo, mediante experimentos en animales -principalmente en ovejas- se ha demostrado que todos los sentidos están activos mientras el feto está in útero: visión, gusto, tacto, audición. Sólo la capacidad olfatoria no ha podido ser demostrada, por estar en un medio líquido.
Profesora Rebeca Slater, sentada al centro, con su equipo de trabajo, tomada de Sjc.ox.ac.uk
Si bien una nueva investigación de la University College London sostiene que los bebés pueden distinguir diferentes estímulos dolorosos recién a partir de la semana 35 de gestación (con reacciones cerebrales específicas, muy similares a las de un niño o adulto), los mismos autores -liderados por la doctora Rebeca Slater- reconocieron que “no podemos afirmar que antes de este cambio en su actividad cerebral los fetos no sientan dolor».
Por otro lado, se trata de resultados que aún deberán ser confirmados a través de otros estudios más amplios y acabados.
Doctor Antonio Lazcano imparte la Conferencia Magistral ElOrigen de la Vida, tomada de Uan.edu.mx
Y a decir del Doctor en Ciencias y Biólogo de la Universidad Nacional Autónoma de México (UNAM) Antonio Eusebio Lazcano Araujo Reyes, hasta la aparición del sistema nervioso central (SNC) la "gastrula" es una masa de células amorfa.
Y agregó: "El (SNC) se desarrolla hasta la semana decimosegunda, más o menos, porque en ese punto hay una transición, pero, en algunos casos sucede más adelante, incluso en la decimosexta semana". E insistió que antes del proceso de aparición del (SNC), el cigoto es una masa de células amorfa.
“Los médicos lo saben mucho más que yo, se puede producir un aborto espontáneo, ¿cuántos abortos espontáneos? No lo sabemos; ¿cuántas embarazadas están perdiendo constantemente cigotos, es decir, óvulos fecundados y nunca se dan cuenta? es enorme”, dijo.
Comentó que el cigoto puede llevar un desarrollo “normal” y el embarazo llega a término o puede dividirse en dos y resulta en gemelos idénticos “homocigóticos” o resultar en una mola hidatiforme, que es un tumor.
Las disertación, aquí descrita, del profesor Lazcano especializado en Biología Evolutiva, fue realizada al impartir la "Conferencia Magistral" ¿Qué es la vida?, que se presentó en el Auditorio Alfonso Caso de la Torre de Humanidades de la UNAM.
Historia de los experimentos con embriones humanos.
En 2015 los investigadores Junjiu Huang y Canquan Zhou, junto a sus colaboradores de la Universidad de Sun Yat-sen en Guangzhou (China) publicaron los resultados de un experimento en el que usaron técnicas de edición genética con las herramientas "CRISPR" sobre embriones humanos, en el laboratorio. Ese estudio genero tras de si una polémica enorme, probablemente por ser el primero, pero los "embriones" que usaron esos investigadores eran defectuosos, y normalmente habrían sido descartados y destruidos al ser producto de Fecundaciones in Vitro (FIV) anómalas en las que dos espermatozoides habían fecundado un solo óvulo. Demostraron que era posible editar genéticamente embriones humanos con "CRISPR" y encontraron los mismos problemas y limitaciones que han encontrado en las demás investigaciones usando embriones de otras especies, como el ratón.
Un año después se autorizó por vez primera el uso de embriones humanos para otro experimento de edición genética en el Reino Unido, a un equipo liderado por la investigadora Kathy Niakan del Centro Francis Crick en Londres. En este caso los científicos usaron embriones humanos normales, producto de (FIV), que ya no eran necesarios para ser gestados y habían sido cedidos por sus progenitores para fines de investigación. Para el año 2017, dicho equipo mostró la gran utilidad de este experimento al constatar que la inactivación de un mismo gen (OCT4) en embriones de ratón o humanos tenía consecuencias muy distintas, mucho más importantes en humanos, que eran incapaces de llegar hasta el estadio de "blastocisto", algo que era desconocido hasta entonces.
La legislación española (tanto la de técnicas de reproducción humana asistida, como la de investigación biomédica) permite el uso de embriones humanos sobrantes de FIV con fines de investigación, con unos requisitos determinados y tras haber obtenido los permisos correspondientes. En ningún caso, ni en el experimento de Niakan ni en los experimentos que se abordarán ahora en España, se pretende implantar los embriones humanos editados genéticamente en una mujer para dar lugar a bebés. No es ese el objetivo de estos experimentos, y esto tiene que quedar muy claro. Eso sería un procedimiento ilegal, además de inseguro y muy arriesgado, como desgraciadamente hemos podido comprobar tras el irresponsable experimento de He Jiankui que conocimos a finales de 2018, y que culminó con él y sus colaboradores condenados e inhabilitados y con el nacimiento de tres niñas con su genoma editado, algo que no debiera haber ocurrido.
Debemos investigar directamente sobre embriones humanos para poder entender cómo se desarrollan, para poder mejorar las eficiencias de los tratamientos de reproducción asistida, cada vez más demandadas por las parejas y las mujeres que desean tener hijos y no lo consiguen. En un porcentaje significativo (alrededor del 15%) de casos no se logra el embarazo y no se sabe bien por qué. Investigando el papel que diversos genes pueden tener en el proceso se podrían mejorar estas técnicas. Y para investigar la función de una serie de genes importantes en el desarrollo inicial embrionario nada mejor hoy en día que las técnicas de edición genética con las herramientas "CRISPR", que permiten inactivar de forma específica cada uno de estos genes y observar sus consecuencias en esta fase temprana del desarrollo de los embriones humanos, recordando que las creadoras de esta metodología fueron reconocidas con el premio Nobel de Química del 2020.
Las herramientas genéticas "Tijeras CRISPR" de las bioquímicas Jennifer Doudna y Emmanuelle Charpentier, tomada de gskpro.com
Ahora bien, en Barcelona trascendió que el equipo formado por los investigadores Anna Veiga, Montserrat Boada y Ángel Raya recibió a principios de diciembre del año 2019, la autorización preceptiva de la Comisión responsable de la reproducción humana asistida para poder realizar experimentos similares a los abordados por Kathy Niakan (nacida en 1977) en España, tras estudiarlo durante 14 meses. En el pasado mes de febrero este equipo, en voz del director del programa de medicina regenerativa, el doctor Raya, ha anunciado que ya fueron autorizados a usar edición genética "CRISPR" sobre embriones humanos sobrantes de fecundación en vitro.
Cabe hacer mención que la bióloga Anna Veiga es pionera en España de la técnica (FIV). Fue responsable del nacimiento de Victoria Anna Perea Sánchez, la primera niña nacida en España el 12 de julio de 1984 producto de una FIV. Por aquel entonces ella trabajaba en la Clínica Dexeus en Barcelona, hoy Dexeus Mujer, cuya actual responsable del laboratorio de reproducción asistida es Montserrat Boada, la que también forma parte del equipo investigador. Por otra parte, Ángel Raya es un experto biólogo molecular del Instituto IDIBELL también de Barcelona, gran conocedor de la biología de las células embrionales, y quien junto a Anna Veiga forman parte del "Programa de Medicina Regenerativa" de este centro de investigación.
Ilustración de la primera edición genética de embriones humanos, tomada de La Vanguardia
Ellos han pretendido hacer pruebas previas a la implantación en el útero. Mucho de lo que sabemos de este periodo lo hemos aprendido estudiando el desarrollo de embriones de ratón. Pero el resultado del experimento de la doctora Niakan demuestra que no todo lo que aprendemos del ratón es extrapolable a humanos.
Son muchas las personas que acuden a las numerosas clínicas de infertilidad humana existentes. Y, por ello, son muchos los embriones humanos que regularmente se generan, producto de FIV. Muchos de estos embriones se usan para su gestación y acaban felizmente en el nacimiento de los deseados hijos, pero otros tantos ya no son necesarios, se mantienen "criopreservados" y pueden destinarse a la investigación, con la aprobación de los progenitores y el oportuno permiso de las autoridades. Serán estos los que usará el mencionado equipo de investigadores. Especialmente aquellos que se congelaron inmediatamente tras la fecundación, en el estado de cigoto, esto es, embriones de una célula. Lo que será un destino adecuado que estos embriones se puedan usar, para fines de investigación responsable, en lugar de permanecer congelados de forma indefinida. Sin duda estos experimentos contribuirán a mejorar la eficiencia de las técnicas de reproducción asistida.
Doctor Jun WU, tomada de Universidad Texas del South Western.edu
Y este panorama señalado en diversos medios españoles, ahora podrá ser superado, la contribución del doctor Jun Wu y su equipo, así como el comandado por el del profesor y también doctor José Polo, abren un nuevo camino para mejorar las investigaciones al respecto. Se hace necesaria la participación de especialistas en diversas ciencias y seguramente de trabajos realizados por grupos de científicos de diversas especialidades.
En el futuro no se cual será la ruta del este tipo de investigaciones, deberán avanzar las legislaciones y los puntos de vista, pero creo se hará este progreso derivado de los descubrimientos que se realicen, es muy temprano para hacer conclusiones, es un panorama similar al que se encontraba vigente en 1984, cuando ocurrió el nacimiento de la primera mujer, producto de la fecundación en vitro en España, una persona adulta que hoy tiene 36 años e edad. Este hecho ahora se aborda con una óptica de todos esos años de haber sucedido y las cosas son diferentes, se perciben distintas a como lo fueron, y como en el futuro lo serán.
Según la Sociedad Española de Fertilidad (SEF), un 8% de todos los niños que nacen actualmente lo hacen con la ayuda de la reproducción asistida.
El Ginecólogo Pedro N. Barri, padre científico de la bebé, que fue la cuarta nacida en Europa y la sexta a nivel mundial, ha resaltado que en 35 años han cambiado muchas cosas en las reproducción asistida, por ejemplo, la edad media de las mujeres que recurren a ella, ha pasado de 35 a 39 años, "y, en este, nuestro centro, un 50 % ya supera los 40 años".
Ana Victoria Perea, primera bebe de probeta en su cumpleaños 35, con el Doctor Pedro Barri, tomada de EFE / Andreu Dalmau / Archivo.
También han evolucionado mucho las técnicas, que ahora permiten, por ejemplo, que un 35.7% de los ciclos de fecundación in vitro (FIV) se hagan con test genético preimplantacional de aneuploidias (DGP) para descartar alteraciones cromosómicas en el embrión, debido a las edades avanzadas de las mujeres que buscan la asistencia para su fecundación.
Según datos de la clínica "Dexeus Mujer", un 22% de las (FIV) son ciclos de transfer diferido, con embriones previamente congelados, y más de un 30% precisan óvulos de donante.
El doctor Barri ha destacado que el nacimiento de Victoria Anna "fue un hito para la ciencia y abrió una puerta a la esperanza para muchas mujeres y familias con problemas de fertilidad. En España, además, marcó un antes y un después, ya que fue el paso definitivo para impulsar el avance y desarrollo de la medicina de la reproducción".
"Cuando empezamos, la mayoría de las mujeres tratadas estaban casadas o vivían en pareja, mientras que actualmente el perfil mayoritario de las pacientes de reproducción asistida son mujeres de edad avanzada, así como mujeres solas o sin pareja masculina y homosexuales que recurren a la fecundación in vitro para crear una familia, lo que ha dado paso a nuevos modelos muy diferentes al concepto tradicional", ha declarado la bióloga Veiga.
La bióloga ha rememorado que los embarazos múltiples y los partos prematuros eran los mayores riesgos en 1984, y actualmente se han reducido muy significativamente, ya que los especialistas consiguen en la mayoría de los casos que se transfiera un solo embrión.
Según los últimos datos de la SEF, correspondientes al año 2016, fueron gemelares en el 17% de los embarazos por (FIV) con óvulos propios, y el 20% de los embarazos con óvulos de donante.
Los especialistas de Dexeus han resaltado que la legislación de su país, ahora es mucho menos restrictiva que en otros países y permite la preservación por motivos sociales y la donación de óvulos de forma anónima, lo que también ha favorecido el llamado ‘turismo’ reproductivo. Estas declaraciones fueron recogidas en una entrevista, realizada el 12 de julio de 2019, a la agencia EFE.
Queda un largo camino por recorrer, pero nunca antes la humanidad estuvo tan bien preparada, contando con espléndidas teorías, puntos de vista novedosos y brillantes, con herramientas tecnológicas sorprendentes y muchos jóvenes entusiastas y deseosos de colmar su vocación con resultados concisos. Soy una vez más optimista en cuanto a los logros que vienen y a la prontitud de su consecución.
















Comentarios
Publicar un comentario